Life Med|脂质纳米颗粒靶向递送mRNA研发策略
湃客:Life Medicine 2022-06-28 07:06
针对近几年席卷全球的新型冠状病毒(COVID-19),疫苗研发一直是布局重点和焦点,被寄予厚望。其中,BNT162b(商品名Comirnaty)和mRNA-1273(商品名Spikevax)两款mRNA纳米疫苗以其极高的保护效率和研发速度闻名于世,并迅速引发国内外广泛关注。目前,以mRNA疫苗为研究热点的核酸疫苗被视为是继(减毒)灭活疫苗、亚单位疫苗之后的第三代新型疫苗,正在引领疫苗研发的潮流,相关产业也正如火如荼的进行中。“新冠”mRNA疫苗的成功同时推动了全球范围内mRNA的产业化进程。 这些事件的背后实际上是mRNA分子优化、体内递送等底层相关技术取得的长足进展,特别是在脂质纳米颗粒(LNPs)递送平台的突破。一般认为,LNPs是递送mRNA最好的选择之一,若要扩宽mRNA的应用场景,研发靶向递送LNPs技术至关重要。

底层技术的发展加速mRNA应用
自20世纪60年代mRNA被发现以来,有关mRNA的应用探索就一刻也不曾停止。mRNA分子具有不稳定性、免疫原性、无法高效进入细胞等特点,在实际应用中非常受限。随着mRNA分子优化技术、递送技术平台的不断发展,这些缺点正在慢慢地被克服。
其一,mRNA分子优化平台,包括有:1)序列优化的进展,如5,3端非翻译区序列的筛选、多聚腺嘌呤(poly A)尾巴的长度优化、开放阅读框(ORF)密码子的优选等;2)核苷酸化学修饰的引入,如5-甲基尿苷和N1-甲基假尿苷的使用不仅能降低mRNA的免疫原性,还能提高其稳定性;3)制备工艺的提升,如体外转录(IVT)放大工艺的成熟、加帽工序的简化、纯化和质检方法的稳定等。其二,递送载体平台,尤其是LNPs递送技术的相对成熟。一般来讲,LNPs由四种成分组成,每种成分都扮演着相对重要的角色:可电离阳离子脂质被认为是LNPs中最重要的成分,它直接决定了mRNA的包裹效率和递送效率;中性辅助磷脂(如DSPC、DOPE)和胆固醇脂质有助于提升LNPs的稳定性以及转染效率;聚乙二醇脂(PEG-Lipid)在调节LNPs尺寸、稳定性、半衰期、递送效率等方面的作用也十分明显。值得指出的是,LNPs中单一成分并非独自行使功能,各组分之间的配比在mRNA的实际应用中非常重要。
通过多手段研发技术,目前LNPs-mRNA已被应用到多个领域,包括疫苗研发、针对多种重大疾病的蛋白替代疗法、基因编辑疗法、细胞疗法等方面。
LNPs靶向递送策略扩宽mRNA应用场景
mRNA精准递送是保证治疗效果的必要条件之一。针对体表的组织器官(如肌肉、眼等)可通过局部给药方式实现,而体内更深层次器官的递送则选择静脉注射更为合适。静脉给药后LNPs介导的肝脏靶向较容易实现,如何实现肝外的选择性递送则具有挑战。针对此科学问题,研究人员尝试了多种策略,取得了不错进展。本亮点文章重点总结了近期发表的几类mRNA靶向递送策略。
(一)靶向分子修饰
在LNPs表面进行靶向分子修饰是实现细胞靶向递送最直接的方法。Jonathan A. Epstein教授团队最近利用CD5抗体修饰包裹了CAR mRNA的LNPs,可提高其体内靶向T淋巴细胞的能力。将上述mRNA制剂静脉注射到心衰小鼠模型后,可在体内对T细胞进行重编程,使其形成有功能的CAR-T细胞,可以靶向过度活跃的心脏成纤维细胞,有效降低了心脏纤维化,并帮助小鼠恢复了心脏功能。Dan Peer教授团队通过重组融合蛋白(MadCAM-1-D1D2-Fc)修饰LNPs技术,将mRNA选择性递送到特定白细胞亚群,在结肠炎小鼠模型中展现出了潜在的治疗前景。不同于抗体修饰,Gabriel A. Kwong课题组最近开发了一种光控的多肽配体置换平台,可快速变换修饰到LNPs表面的靶向抗原多肽,在体内实现对多种抗原特异性T细胞群的靶向mRNA递送。以上修饰技术可显著增强对特定细胞类型的靶向递送能力,但在特异性方面略显不足。
(二)高通量筛选
上文提到,可离子化阳离子脂质是LNPs中最重要的成分。通过结构各异的化学结构库进行高通量筛选早已被证实是研发靶向LNPs最为有效的方法之一,目前大多数LNPs是由此技术研发产生的,可实现肝、肺、脾、脑等器官的mRNA递送,但此方法相对盲目、工作量大。James Dahlman课题组结合“DNA条形码”和深度测序技术,开发了一种新型的高通量筛选技术,简称为FIND,可显著提升LNPs的筛选效率。他们将Cre mRNA和特定序列的DNA条形码包裹到同一个LNPs中,只需设计不同的DNA条形码就可制备出带有特定“标签”的一系列LNPs-mRNA药物。将这些“标签”各异的LNPs通过静脉一起注射到Cre诱导表达tdTom的转基因小鼠中,利用流式细胞仪检测tdTom阳性细胞,并结合DNA深度测序的方法可鉴别出特定细胞靶向的LNPs载体。通过该体系,他们可同步筛选超200种LNPs,显著提高了LNPs的筛选效率。
(三)可预测性LNPs优化
区别于高通量筛选,如果给出明确的LNPs设计原则,则会大大缩短研发周期,提高研发效率。Daniel Siegwart课题组2020年在Nature Nanotechnology上报道了一种可预测性设计的LNPs研发技术,命名为SORT。在原有4组分LNPs基础上,仅添加一种带有不同电荷的新脂质分子(SORT分子),则可实现mRNA在小鼠的肝脏、脾脏、肺部的靶向递送和基因编辑。通过增加阳离子脂质能够使mRNA特异递送进入肺部;阴离子脂质能够使mRNA特异进入脾脏;而可离子化阳离子脂质则会增强肝脏的靶向递送。重要的是,SORT技术具有普适性,可在多种类型的LNPs基础上快速研发出肝外器官靶向LNPs。进一步机制探究发现,SORT分子可调控SORT-LNPs在器官水平的生物分布、LNPs自身pka、及表面血清蛋白冠等,这些因素最终决定了LNPs在体内的靶向递送能力。文中指出,在器官靶向递送方面,LNPs表面的血清蛋白冠起到最关键作用,识别这些独特的蛋白质可能会在未来研发靶向其他器官的LNPs方面有所帮助。
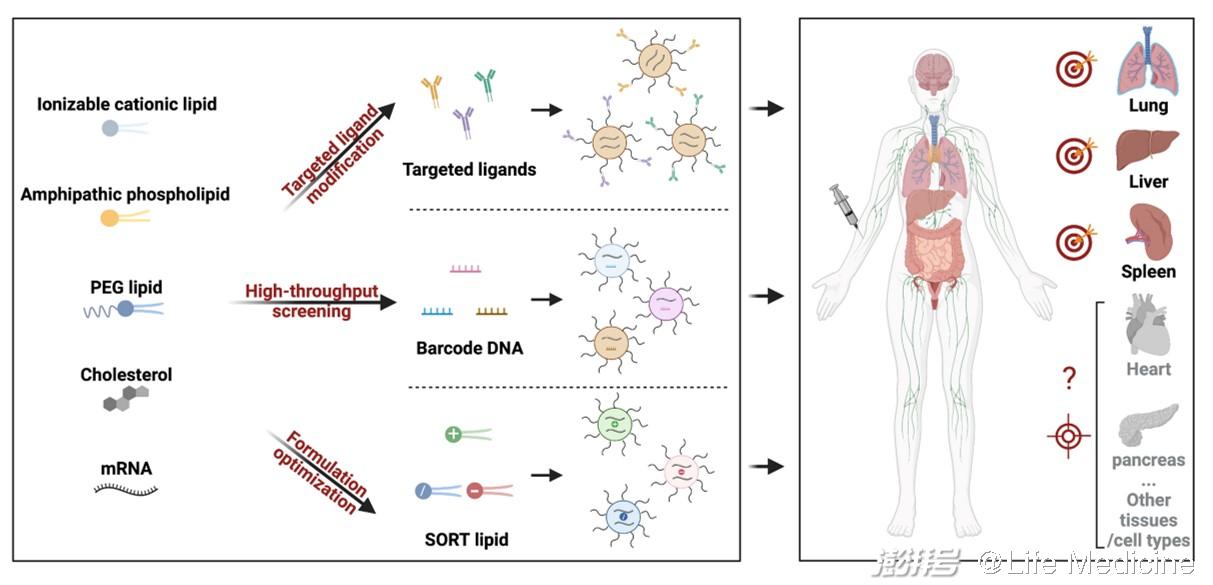
图1. 体内靶向递送mRNA-LNPs的研发策略。
总结与展望
器官选择性递送对于拓宽mRNA临床应用至关重要。本文提到的几种代表性策略在一定程度上提出了解决方案,但各有不足之处。如何开发出靶向其他重要器官(如心脏、胰腺、肾脏)的LNPs、如何实现对特定脏器中特定细胞类型的靶向递送都是未来需要解决的重要问题。随着研究人员对mRNA靶向递送技术的深入研究,相信未来会有更多的靶向递送策略研发出来用于精准医疗研究。
参考文献:
Cheng, Q., et al. (2020). Selective organ targeting (SORT) nanoparticles for tissue-specific mRNA delivery and CRISPR-Cas gene editing. Nat Nanotechnol 15, 313-320.
Dammes, N., et al. (2021). Conformation-sensitive targeting of lipid nanoparticles for RNA therapeutics. Nat Nanotechnol 16, 1030-1038.
Dilliard, S.A., et al. (2021). On the mechanism of tissue-specific mRNA delivery by selective organ targeting nanoparticles. Proc Natl Acad Sci USA 118, e2109256118.
Han, X., et al. (2021). An ionizable lipid toolbox for RNA delivery. Nat Commun 12, 7233.
Kong, N., et al. (2022). Intravesical delivery of KDM6A-mRNA via mucoadhesive nanoparticles inhibits the metastasis of bladder cancer. Proc Natl Acad Sci U S A 119, e2112696119.
Liu, S., et al. (2021). Membrane-destabilizing ionizable phospholipids for organ-selective mRNA delivery and CRISPR-Cas gene editing. Nat Mater 20, 701-710.
Rurik, J.G., et al. (2022). CAR T cells produced in vivo to treat cardiac injury. Science 375, 91-96.
Sago, C.D., et al. (2018). High-throughput in vivo screen of functional mRNA delivery identifies nanoparticles for endothelial cell gene editing. Proc Natl Acad Sci U S A 115, e9944-e9952.
Su, F.Y., et al. (2022). In vivo mRNA delivery to virus-specific T cells by light-induced ligand exchange of MHC class I antigen-presenting nanoparticles. Sci Adv 8, eabm7950.
Xiao, Y., et al. (2022). Emerging mRNA technologies: Delivery strategies and biomedical applications. Chem Soc Rev, DOI: 10.1039/d1cs00617g.
原文链接://doi.org/10.1093/lifemedi/lnac004
