目前SARS-CoV-2临床试验用脂质纳米颗粒的开发
mRNA最早的转染试剂是季铵化阳离子DOTAP结合可电离和融合的DOPE,采用DNA转染[85],用于在众多细胞类型中转染mRNA[86]。尽管在体外有效,但永久性阳离子季铵基团使这些大尺寸的脂复合物从循环和其通常靶器官肺中迅速清除,并表现出毒性。今天LNP的先驱是稳定的质粒-脂质颗粒(SPLP),它是由融合基因电离的DOPE与季铵化的阳离子脂质DODAC结合形成的,DODAC静电结合并包裹质粒DNA,然后用亲水性PEG包被,使其在水介质中稳定,并在体内给药时限制蛋白质和细胞相互作用[87]。DOPE在细胞摄取后可在内涵体中质子化,由于呈锥形,因此可与内涵体磷脂形成内体溶解离子对,以促进内涵体释放,这是成功递送的关键事件[17]。然后进一步将SPLP开发为含有siRNA的稳定核酸脂质颗粒(SNALP),包括四种脂质:离子化而不是季铵化阳离子脂质、饱和双层形成季铵化两性离子脂质、DSPC、胆固醇和PEG脂质[88]。除了与核酸静电结合外,SNALPs中的可电离脂质发挥了融合脂质的作用,并在内涵体中质子化,与内涵体磷脂形成膜不稳定离子对。目前已知DSPC有助于在PEG表面下形成稳定的双层[89]。胆固醇发挥多种作用,包括填补颗粒间隙、限制LNP–蛋白质相互作用和可能促进膜融合[90]。可电离脂质在生理pH下呈中性,从而消除循环中的任何阳离子电荷,但在pH~6.5的内体中质子化,促进内体释放,发挥核心作用。
2018年临床批准的首个siRNA产品的开发主要集中在优化可电离脂质,其次是PEG脂质和LNP中使用的四种脂质的比例,以及LNP组装和生产程序。根据分子形状假设[12,91],发现C18尾中不饱和键的最佳数量是通过醚连接到二甲胺头基的二亚油酸尾[88]。然而,在亚油酸尾部引入单个连接体,其具有从二甲胺头基到连接体的优化碳数,导致LNP中可电离脂质DLin-MC3-DMA的pKa接近6.4[92,93]。优化的最后一步是将MC3/DSPC/胆固醇/PEG–脂质的这些脂质摩尔比调节至50/10/38.5/1.5。总体从DLin-DMA到DLin-MC3-DMA的这一优化过程需要在数千种制剂中筛选超过300种可电离的脂质,并导致效价增加200倍和有效剂量相应减少,以实现对靶基因> 80%的持久抑制和允许治疗窗,2018年Onpattro™获得临床批准[94,95]。这种为siRNA开发的MC3配方是随后开发LNPs的基础,如下所述(图1),在被批准用于SARS-CoV-2 mRNA疫苗的递送后,LNPs现在正被紧急使用。
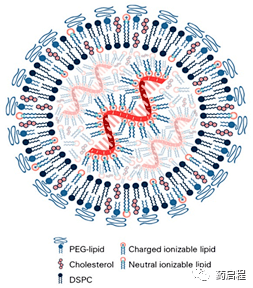
图1 mRNA脂质纳米颗粒结构。最近使用冷冻电子显微镜[96]、小角中子散射和小角X射线散射[89]进行的研究表明,mRNA脂质纳米颗粒包括低拷贝数的mRNA(1-10),并且mRNA与占据LNP中心核心的可电离脂质结合。聚乙二醇(PEG)脂质形成脂质纳米颗粒(LNP)的表面,同时形成双层的DSPC。带电荷和不带电荷的胆固醇和可电离脂质可分布在整个LNP中。其他输送系统的结构示意图在最近的综述中提供[14]。
Moderna使用上述Onpattro制剂中的MC3进行了几项临床前[97,98,99]和临床研究[97,100],以递送核苷修饰的mRNA编码免疫原。在这些比较新的一类可电离脂质与MC3的研究中,MC3后来被确定为可电离脂质[42,101]。这个新类别包括Lipid H[42],它是Moderna的SARS-CoV-2产品mRNA-1273中的可电离脂质SM-102[41](表2)。
使用针对寨卡病毒的核苷修饰的mRNA编码免疫原,MC3 LNP能够保护缺乏I型和II型干扰素(IFN)信号的免疫功能低下小鼠免受10µg剂量1次或2µg剂量初免-加强免疫设计的致死攻击[99]。在预先给予抗ifnar1阻断抗体以建立致死模型的免疫功能正常小鼠中也获得了相似的结果。在一系列递送核苷修饰的mRNA编码血凝素(HA)免疫原的流感研究中,皮内递送的MC3 LNP能够完全保护小鼠免受低至0.4µg单次给药的致死性攻击,尽管即使单次给予高达10µg剂量,攻毒后也会出现体重减轻[97]。雪貂单次给予50µg或100µg剂量产生了较高的HAI(血凝抑制试验)滴度,非人灵长类动物单次给予200或400µg剂量也产生了较高的HAI滴度。在接受100µg剂量的少数(23)人类受试者中,在研究开始时,所有受试者的HAI滴度均 > 40(who保护相关性),比基线高4倍以上。在一项更大规模的1期试验中,使用相同的MC3 LNPs递送两种不同的核苷修饰的mRNA编码的HA免疫原,肌肉注射100µg的H10N8免疫原导致23名受试者中100%的HAI滴度 > 40[100]。尽管未发生危及生命的不良事件,但这23例受试者中有3例发生了重度3级不良事件。3例受试者中的2例发生3级不良事件(符合研究暂停规则)后,停止计划的400µg给药。在较低剂量下,不良事件的频率和严重程度降低,但几乎每例受试者均发生至少1起不良事件。这些研究很有前景,但也强调了在不会引起问题数量的不良事件的剂量下获得保护性免疫的治疗窗相对较窄。这让人想起MC3前体DLin-DMA的治疗窗窄,需要提高效力才能降低剂量,仍然实现有效的基因敲低。
表2脂质纳米颗粒中使用的可电离脂质。脂质纳米颗粒中使用的可电离脂质的一个关键特征是,通过TNS染料结合试验测定,LNP中可电离脂质的pKa应在6-7范围内。理论上计算的大多数可电离基团的pKa在8-9.5范围内,如下所示在氮原子上,使用商业软件理论上估计水介质中的这些值。pKa从理论值下降2-3个点至TNS值是由于脂相中质子的溶剂化能量更高,导致脂相中的pH值比水相高2-3个点,在TNS测定期间测量pH值[102]。
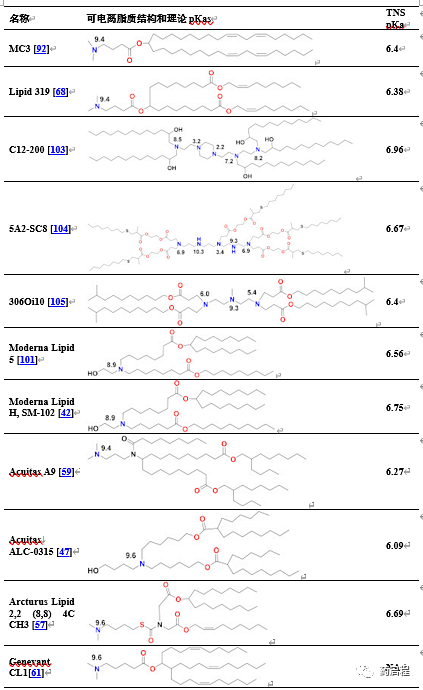
由于siRNA产品需要重复给药治疗慢性疾病,人们担心MC3中二亚油酸烷基尾的缓慢降解会导致重复给药的蓄积和潜在毒性。MC3的生物可降解版本脂质319(表2)是通过用在体内易于被酯酶降解的伯酯取代每个烷基链中两个双键中的一个而产生的[68]。观察到脂质319在肝脏中的半衰期小于1小时,而其在肝脏中保持与MC3相似的基因沉默效率。在体内证实了降解产物,以及其分泌和脂质319的无毒性质。在SARS-CoV-2的临床前和临床研究中引用了脂质319的研究,作为BioNTech[49]和CureVac[53,69]产品中使用的Acuitas LNP类别,尽管在伦敦帝国理工学院试验[60]中Acuitas LNP递送的自扩增RNA被引用为包含在最近的专利申请中[59],这里由Acuitas的Lipid A9代表(表2)。最近,BioNTech批准的BNT162b2中Acuitas可电离脂质的同一性被披露为ALC-0315[40](表2)。这些LNPs的一个重要方面是,它们是通过筛选IV给药后肝脏中的mRNA表达而开发的,可能还没有完全优化用于基于mRNA的疫苗的肌内给药。
Moderna最近开发了一类新的可电离脂质来替代MC3,主要是由于上述与MC3降解缓慢相关的问题,但也努力通过实现比二亚油酸MC3烷基尾更大的分支来提高其效力[42,101]。这类新脂质具有乙醇胺可电离头基,与含有一级降解酯(如Maier 2013)的单个饱和尾连接,并与第二个饱和尾连接,后者使用降解性较低的二级酯在7个碳原子后分支成两个饱和C8尾,如脂质5[101](表2)。优化用于肝脏IV给药,发现相似的脂质H[42]或SM-102是疫苗肌内(IM)给药的最佳选择。分支增加是Acuitas追求的共同特征,因为Lipid A9共有5个分支链[59](表2),而Moderna LNPs有3个分支链。分支增加被认为可产生具有更多锥形结构的可电离脂质,因此,当与内体中的阴离子磷脂配对时,将发生更大的膜破坏能力,遵循几十年前概述的分子形状假设[12,91]。当IV给药时,24h时在肝脏中检测不到脂质5,而MC3以其初始剂量的71%存在于肝脏中,验证Lipid 5的降解性。IV给药后,Lipid 5在小鼠中荧光素酶表达的效力是MC3的3倍,在非人灵长类动物中hEPO的效力是MC3的5倍。这些效力的增加与胞内体释放增加一致,可能是由胞内体释放增加引起的,对于Lipid 5,细胞中高达15%的mRNA从胞内体释放,而MC3为2.5%,后者与之前使用siRNA测定的MC3的结果相似[106]。然而,在这些内体释放实验中,MC3的细胞摄取是Lipid 5的4倍,因此这两种LNPs在细胞质中释放的mRNA的绝对量相似。在疫苗的肌内给药中检查了相同的可电离脂质库,同样发现可降解,并且由于伯酯而迅速消除,并且对于流感核苷修饰的mRNA%__,与MC3相比,在蛋白表达或免疫原性方面效价通常增加3-6倍。小鼠中%编码的免疫原,尽管非人灵长类动物中的免疫原性与5µg初免-加强免疫剂量下的MC3相同[42]。脂质H或SM-102(表2)被确定为最佳候选药物,在结构上仅与通过伯酯的二碳置换确定为IV给药最佳的脂质5不同。脂质5 LNP的pKa为6.56,而脂质H LNP的pKa为6.68,表明IM与IV给药相比,pKa略微增加可能有益,尽管该差异在试验的变异性范围内。大鼠肌肉注射部位的组织学检查表明,与MC3相比,Lipid HLNPs吸引的中性粒细胞和巨噬细胞富集的炎性浸润较少,这可能会降低人体试验中注射部位的反应原性[42]。
目前SARS-CoV-2临床试验中的mRNA脂质纳米颗粒
5.1.BioNTech/Pfizer
Acuitas ALC-0315(表2)结合DSPC、胆固醇和PEG脂质是BioNTech SARS-COV-2试验中的递送系统[40]。CureVac和伦敦帝国理工学院也可能使用ALC-0315,或可能使用A9(表2)。
BioNTech开始用4种mRNA编码的免疫原开发其SARS-CoV-2疫苗,其中2种是核苷修饰的,1种是未修饰的,1种是自我扩增的。有两种核苷修饰的mRNA的报道:BNT162b1是编码刺突蛋白受体结合域的短的~1kb序列,通过foldon三聚体结构域修饰,通过多价显示增加免疫原性。较长的4.3kb BNT162b2编码一个二脯氨酸稳定的全长膜结合刺突蛋白。BNT162b2最近获得了欧盟和美国的紧急批准。
在一项临床前研究中,小鼠单次给予0.2、1和5µg BNT162b2后,可检测到结合抗体和中和滴度。从最低剂量到最高剂量增加一个数量级,在Th2细胞因子水平非常低的CD4 + 和CD8 + 脾细胞中引起强烈的抗原特异性Th1 IFNγ和IL-2应答[49]。引流淋巴结中还含有大量生发中心B细胞以及CD4 + 和CD8 + 滤泡辅助性T(Tfh)细胞计数升高,这些细胞先前被确定为mRNA LNP疫苗中LNP单独诱导的一部分[33]。在非人灵长类动物中,30µg或100µg的初免-加强免疫剂量引起的结合抗体和中和滴度是人恢复期试验组的10倍以上,并且产生强烈的Th1偏倚T细胞应答,该应答被认为对预防疫苗相关的增强呼吸道疾病很重要[107]。在有限数量(6)的攻毒恒河猴中,两次100µg剂量在支气管肺泡灌洗和鼻拭子中检测不到病毒滴度。
较小mRNA编码免疫原BNT162b1的1期临床试验计划在第1天和第21天给予10、30和100µg剂量。中等剂量30µg诱导的抗体结合和中和滴度分别是人恢复期组的30倍和3倍。由于首次给药后存在重度注射部位疼痛,因此未给予100µg剂量进行加强剂量。30µg加强剂量组100%的受试者报告了注射部位疼痛,但严重程度为轻度或中度。以30µg剂量第二次接种疫苗后,几乎所有受试者均发生轻度或中度全身不良事件发热、寒战或疲乏。该试验还证明了外周血单核细胞对Th1偏倚T细胞的强烈应答[50]。
一项2期试验在年轻(18-55岁)和年长(65-85岁)受试者组中比较了BNT162b1和BNT162b2[51]。老年受试者的结合和中和抗体滴度略低,但仍超过恢复期组。与年轻受试者相比,老年受试者的不良反应严重程度也降低。与BNT162b1相比,在BNT162b2中发现全身不良事件(发热、寒战、疲乏)的频率显著降低约两倍。正是BNT162b2耐受性的增加推动了其选择进入3期试验,最近宣布了94%的有效性,因为在安慰剂组中发生了162例COVID-19病例,而在接受两次30µg BNT162b2给药的疫苗接种组中仅发现了8例病例[3]
5.2. Moderna
在Moderna的研究中,核苷修饰的mRNA编码免疫原是一种跨膜锚定的二脯氨酸稳定的融合前刺突,具有天然的furin裂解位点,并在原型MC3 LNP基础上的LNP中递送,只是用Lipid H(SM-102)替代MC3[41,42]。该mRNA LNP(mRNA-1273)在第1天和第21天以1µg剂量注射时在几种小鼠种属中诱导中和抗体,但在0.1µg剂量时未诱导中和抗体[44]。T细胞应答似乎是平衡的Th1/Th2应答,在小鼠适应的病毒攻毒模型中,小鼠肺和鼻甲中的病毒滴度在2次剂量1µg给药后降低至基线,但在0.1µg给药后未降低。在恒河猴中,2剂100µg剂量在外周血中产生高结合和中和滴度以及Th1偏倚反应,也涉及强烈的Tfh反应[45]。两个10µg剂量组的滴度和T细胞应答显著降低。同样,100µg剂量能够将支气管肺泡灌洗液和鼻拭子中的病毒滴度降低至基线,而10µg仅在肺部降低。
在1期研究中,每组15例患者接受2剂25、100或250µg,间隔4周,结合和中和滴度比100µg剂量的恢复期高约10倍,约相当于25µg的恢复期[46]。100µg和250µg剂量组所有受试者均报告征集性不良事件,250µg组14例受试者中的3例报告重度不良事件并停药。在随后的老年患者(56-71岁和71岁以上)1期研究中,发现25µg和100µg剂量产生的结合抗体滴度高于恢复期血浆,而100µg剂量的中和滴度相当,但低于25µg剂量的恢复期[43]。大多数患者(约80%)在第二次接种疫苗后仍发生不良事件,即使是在老年组。外周血分析显示CD4 T细胞应答存在Th1偏倚。与25µg剂量相比,100µg剂量的中和滴度更高,因此选择该剂量用于3期试验,中期结果显示90例COVID-19病例在安慰剂组与5例在疫苗接种组具有94.5%的有效性[2]。一个独立的委员会对Moderna的3期试验进行了中期分析,发现严重不良事件包括9.7%的参与者出现疲劳,8.9%出现肌肉疼痛,5.2%出现关节痛,4.5%出现头痛,而在辉瑞/BioNTech的3期试验中,频率较低的是疲劳为3.8%,头痛为2%[108]。
5.3. CureVac
The CureVac mRNA LNP(CVnCoV)是一种非化学修饰的序列工程mRNA,编码在Acuitas LNP中递送的二脯氨酸稳定的全长S蛋白,可能使用可电离脂质ALC-0315。在小鼠中使用2µg剂量时,检查了两次给药之间的周数,范围为1-4周,发现Balb/c小鼠中较长的间隔产生了较高的滴度和T细胞应答以及平衡的Th1/Th2应答[53]。需要第二次给药以产生中和抗体,0.25µg的两次给药不足以产生中和抗体。在叙利亚金黄地鼠中,两次10µg剂量(而非2µg)能够将肺(而非鼻甲)中的病毒滴度降低至基线。
在检查2-12µg剂量的1期临床试验中,仅在最高12µg剂量下发现达到恢复期血清水平的中和滴度,导致正在进行的2期试验纳入更高剂量16和20µg[52]。接受12µg剂量的所有患者在每次给药后均发生全身不良事件,大多数为中度和重度,而 > 80%的患者在轻度和中度水平发生局部注射部位疼痛。
5.4. TranslateBio
Translate Bio使用非修饰的mRNA编码双突变形式的二脯氨酸稳定的刺突蛋白,并通过被引用为基于可电离脂质C12-200[109]的LNP进行递送,其可能是最近从ICE-[110]或基于半胱氨酸的[55]可电离脂质家族合成的候选物。在Balb/c小鼠中,0.2–10µg范围内的两次给药导致结合和中和滴度远高于恢复期水平。在非人灵长类动物中,15、45和135µg剂量产生的滴度均超过人恢复期组[56]。免疫应答也存在Th1偏倚。
5.5. Arcturus
Arcturus使用自扩增、全长、未修饰的mRNA编码融合前SARS-CoV-2全长刺突蛋白,通过LNP进行递送,该LNP使用可电离脂质与硫酯,通过两个额外的酯基将含胺的头基与脂质尾部连接。该家族中两种可能的可电离脂质是脂质10a([111]的表4)或脂质2,2(8,8)4 C CH3([57]的第33页)(表2)。后者有三个分支,类似于Moderna Lipid H,但有一个可降解的硫酯与头基连接。观察到自身扩增mRNA的特征,即IM给药后1周以上,荧光素酶报告基因表达维持在相当恒定的水平,而常规mRNA表达迅速下降[58]。
单独接种疫苗在C57BL/6小鼠中产生了令人惊讶地体重减轻和临床评分增加。小鼠中仅需要2µg或10µg(而非0.2µg)单次给药,即可在Th1偏倚应答中达到高于100的中和滴度,并具有高水平的抗原特异性T细胞应答。在K18-hACE2致死小鼠激发模型中,2µg或10µg单次给药也具有100%保护作用,100%存活,无体重减轻,肺和脑病毒滴度降低至基线水平。Arcturus已经完成了1期临床试验,剂量为1-10µg,并选择7.5µg进行3期试验[112]。
5.6.帝国理工学院
伦敦帝国理工学院使用Acuitas LNP递送的自扩增mRNA编码的融合前稳定的刺突蛋白,该LNP在Lipid A9[60]代表的专利[59]中进行了描述(表2)。在Balb/c小鼠两次注射0.01µg至10µg剂量范围后,获得了较高的剂量依赖性抗体和中和滴度。该应答存在强烈的Th1偏倚,与较低的0.1和0.01µg剂量相比,10和1µg剂量产生的抗原特异性脾细胞应答高3倍。这种疫苗的1期临床试验即将开始。
5.7.朱拉隆功大学、宾夕法尼亚大学
朱拉隆功大学与宾夕法尼亚大学合作,正在使用Genevant LNP(可能是CL1脂质)开发一种天然的加标免疫原核苷修饰的mRNA LNP[61]。他们的目标是在2021年第1季度开始1期临床试验,并在2021年第4季度开始将疫苗分发给泰国和7个周围的低至中等收入国家。
5.8. Providence Therapeutics
Providence Therapeutics被授予加拿大卫生部许可进行PTX-COVID-19B mRNA LNP疫苗人体临床试验的通知[113]。C57BL6小鼠按照初免-加强免疫方案接受20µg剂量给药后,对编码受体结合域(furin裂解位点有或无突变的全长加标物)的三种mRNA候选物进行临床前研究[114]。来自Genevant未披露脂质的临床前数据结果(可能与表2中的CL1相似)显示出对于全长和furin突变有效负载的稳健中和滴度,与[115]中观察到的数据相似。1期临床试验计划于2021年第一季度开始,疫苗的生产和分销——等待监管批准——在同年进行。
5.9.储存和分销
大多数在实验室中制造的RNA LNPs在4 °C下可稳定数天,但随后表现出体积增大和生物活性逐渐丧失,如荧光素酶表达[116]。在之前的siRNA LNP制剂中,通常观察到LNP聚集的大小随时间增加[117]。为了稳定用于储存和分销的mRNA LNP疫苗,迄今为止需要冷冻形式。Moderna COVID-19疫苗需要在-25 ℃~-15 ℃保存,但在2 ℃~8 ℃之间也可稳定长达30天,在8 ℃~25 ℃之间可稳定长达12 h[118]。辉瑞/BioNTech COVID-19疫苗需要在-80 ℃至-60 ℃下储存,然后解冻并在2 ℃至8 ℃下储存长达5天,然后在注射前用生理盐水稀释[119]。
与Moderna疫苗所需的常规冷冻温度相比,辉瑞疫苗在分销和储存期间所需的干冰温度更难达到。这些温差背后的原因并不明显,因为两种疫苗均含有相似的高浓度蔗糖作为冷冻保护剂。Moderna mRNA LNPs在Tris和醋酸盐两种缓冲液中冷冻[41],而Pfizer/BioNTech疫苗仅使用磷酸盐缓冲液[40]。已知磷酸盐缓冲液对冷冻不理想,因为其易于沉淀,并在冰结晶开始时引起pH值突然变化[120,121]。冻干对于mRNA LNPs一直具有挑战性[116]。然而,Arcturus表示,他们的COVID-19 mRNA疫苗在冻干形式下是稳定的,这大概会大大简化分布,尽管这种冻干制剂的温度稳定性尚未披露[122]。
原文来源:Automated Manufacture of Autologous CD19 CAR-T Cells for Treatment of Non-hodgkin Lymphoma.Front.Immunol.11:1941. DOI:10.3389/fimmu.2020.01941